
新型冠状病毒感染(COVID-19)是一种新发现的由非分段单链核糖核酸(RNA)-β冠状病毒引起的传染病,该冠状病毒被命名为严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2),近三年在世界范围内大流行,根据Worldometer实时在线数据的统计,截至2022年6月30日,全球确诊新型冠状病毒感染病例累计达5 亿4874万例,死亡达到633万例。该病毒通过呼吸系统肺部形成感染,进入肺泡表面的受体血管转换酶2(ACE2)与病毒棘突蛋白结合,介导进入宿主细胞,通过血液循环到达全身各个器官致病,因此,SARS-CoV-2不仅损伤肺脏,还潜在性对多器官系统损伤,如心脑血管、凝血、胃肠道、神经系统及内分泌系统甲状腺等器官[1]。疫苗接种过程中发也现,COVID-19疫苗接种后一段时间患者出现亚急性甲状腺炎等疾病;有文献报道,在COVID-19感染期间或之后与内分泌系统相关的甲状腺疾病[2]。有些腺病毒疫苗不含佐剂,同样也出现了亚急性甲状腺炎病例。近三年新冠疫情的发生,医生对此传染病了解相对较少,并发症处置临床经验少,从全世界大流行过程中发现与新冠有关记录的亚急性甲状腺炎的个案报道,通过报道也显示与其他病毒一样是亚甲炎的发病因素[3]。本文就全世界范围内确诊的COVID-19感染后亚急性甲状腺炎的病例报告与新冠疫苗接种后亚急性甲状腺炎的病案做一总结回顾,旨在探讨引起亚甲炎的原因并非佐剂免疫结果的学说。1资料来源与回顾
1.1检索方法
通过计算机综合文献检索系统,在医学检索网站PubMed、MEDLINE和中国知网(CNKI) 数据库来查找已发表的符合我们需求的主题文章,检索关键词:“SARS-CoV-2 infection”或“COVID-19 Vaccination”或“COVID-19”或“冠状病毒肺炎疫苗”或“冠状病毒肺炎感染”和“De Quervain”或“甲状腺炎”或“甲状腺疾病”或“亚急性甲状腺炎”或“subacute thyroiditis”或“疫苗接种”或“covid-19 vaccination”和“case report”。检索时间范围在2020年1月到2022年6月30日,以英文检索为主,兼以识别其它研究领域的文章,以扩大资料的检索范围,也可把检索到的符合条件文章参考文献再次进行检索筛选。病例的选择研究是在没有任何商业利益和经济利益的前期下进行的,不存在作者之间任何潜在的利益冲突。
1.2研究病例选择
首先选择个案报道,对COVID-19疫苗接种后发病的个案报告病例均进行仔细阅读评估,其核酸检测阴性病例或者病毒特异性检测IgG和IgM抗体阴性,有明确的COVID-19疫苗接种史,有典型的亚急性甲状腺炎(STA)临床表现,有完整的甲状腺功能检查的参数指标者。检索排除标准:排除其他病毒感染,排除无亚急性甲状腺炎的治疗方案,以及治疗后无定期随访数据资料者;除不符合本次检索目的资料的文章,编辑来信,评论性文章,综述性文章;排除风湿性等免疫性病例类文章和疫苗引起的未明确特征的研究性文章或者重叠性报告病例。
同样对检索到新冠病毒感染后确诊的亚急性甲状腺炎患者的个案报道进行仔细评估,核酸检测阳性病例或者病毒特异性检测IgG和IgM抗体阳性,有亚急性甲状腺炎(STA)临床表现,有完整的甲状腺功能检查的参数指标。检索排除标准:排除其他病毒感染,排除无亚急性甲状腺炎的治疗方案,以及治疗后无定期随访数据资料者,除不符合本次检索目的的资料的文章,评论性文章,综述性文章同上。
病例筛选是两组人员分组进行,两位研究者均应用统一的纳入和排除标准,经过独立审查检索文章的标题和关键词。然后,这两位研究人员独立审查了文章全文以确定其最终收录研究,最后两组统一分歧,取消不同意见的病例(图1)。
1.3数据提取
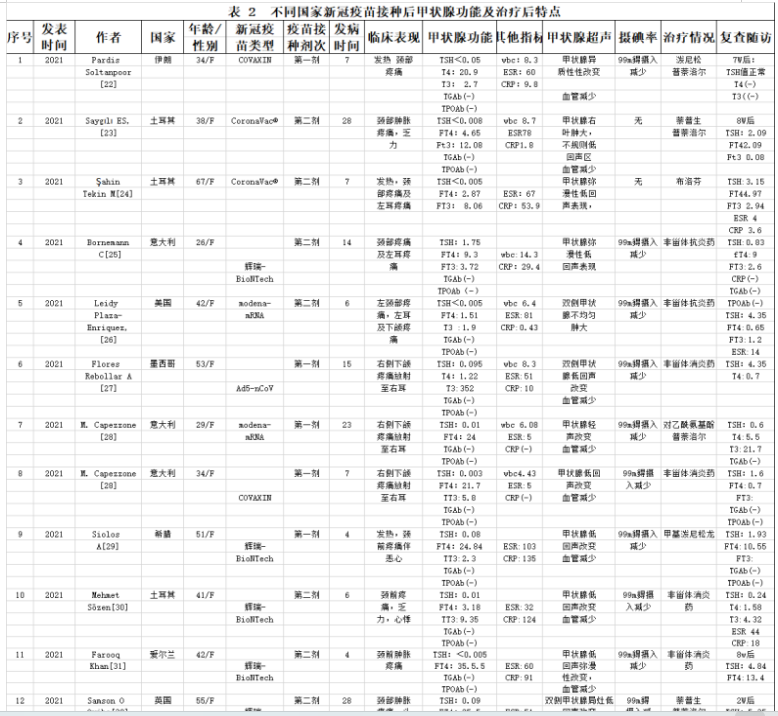
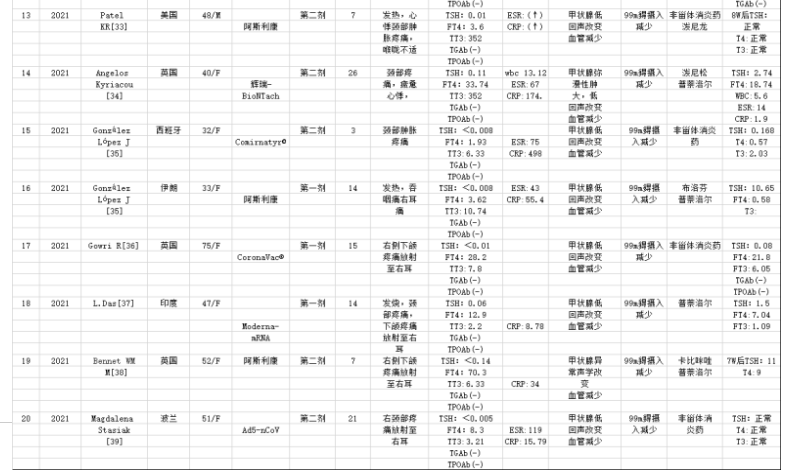
每项纳入的研究者提取有关信息(作者、期刊、出版年份和来源国)。记录了人口统计学、既往甲状腺疾病史、疫苗类型、COVID-19疫苗接种、STA发病时间、STA临床表现、甲状腺功能实验室检查、炎症指标、甲状腺超声和/或99锝闪烁显像以及治疗后好转与随访。甲状腺功能包括促甲状腺素(TSH)水平,血清游离三碘甲状腺原氨酸(FT3)浓度,游离甲状腺素(FT4),甲状腺过氧化物酶抗体(TPOAb),甲状腺球蛋白抗体(TgAb),甲状腺受体抗体(TRAb);炎症指标包括C反应蛋白(CRP)和红细胞沉降率(ESR)结果等方面内容,从报告中提取的数据接近完整的。初步发现39篇新冠肺炎病毒感染与亚急性甲状腺炎符合相关记录。剔除不符合研究目标的重复论文,综述和疫苗相关甲状腺炎病例。只有完整报告和实验数据和跟踪数据病例39例被纳入系统评价,值得注意的是,发现大样本的文章都是一样的个案积累。39例病例研究资料发表于2020年1月1日至2022年6月30日,作者来自全球15个国家报告的新冠病毒与亚急性甲状腺炎诊断的不同病例:其中意大利8例,西班牙4例,美国5例,俄罗斯2例,菲律宾1例,新加坡1例,日本1例,土耳其4例,印度2例,墨西哥2例,伊朗3例,英国3例,爱尔兰1例,希腊1例,波兰1例[4-39]。
1.4 统计学方法 分类资料输入EXCEL表格,spss统计软件分析,计数资料应用比较卡方检验,计量资料进行t检验,P﹤0.05说明有显著统计学意义。
2.1收录对象的一般特征
收录对象来自不同的国家和地区,年份为2020年、2021年、2022年报道的完整病例,包括新冠肺炎病毒感染和新冠病毒肺炎疫苗接种后确诊的亚急性甲状腺炎的患者39例,其中2020年11例2021年28例,2022年0例,剔除报道病例中没有陈述患者有既往免疫病史,否认有慢性病史,无近期的腮腺炎病毒,巨细胞病毒,肠病毒和柯萨奇病毒感染,患者均有新冠肺炎病毒感染的病史和证据,即COVID-19核酸检测阳性。新冠感染患者群体中以女性为主,其中男性4例(占21.05%),女性15例,(占78.95%),年龄在18-58岁,平均年龄(39.52±11.14)岁。新冠病毒疫苗接种后亚急性甲状腺炎患者发病同样也是以青年女性为主,其中男性1例,(占5%),女性19例(占95%),年龄在26—75岁,平均年龄平均年龄(43.2±10.29)岁。男女性别之间无显著性差别(p>0.05),两组研究对象在年龄方面比较无显著性差异(t=1.07,p>0.05)。患者均存在典型的亚急性甲状腺炎的临床表现,发热,出汗,颈部疼痛、乏力和心悸等症状。通过流行病史,临床表现,核酸检测证据,甲状腺功能指标,一般炎症反应指标,甲状腺超声检查,吸碘率或者高锝酸盐99mTc闪烁显像等检查治疗,有治疗措施和完善的后续复查等内容。除了发热的百分率比较有一定的差别外(P<0.01),其他指标一致,(表1,表2)。
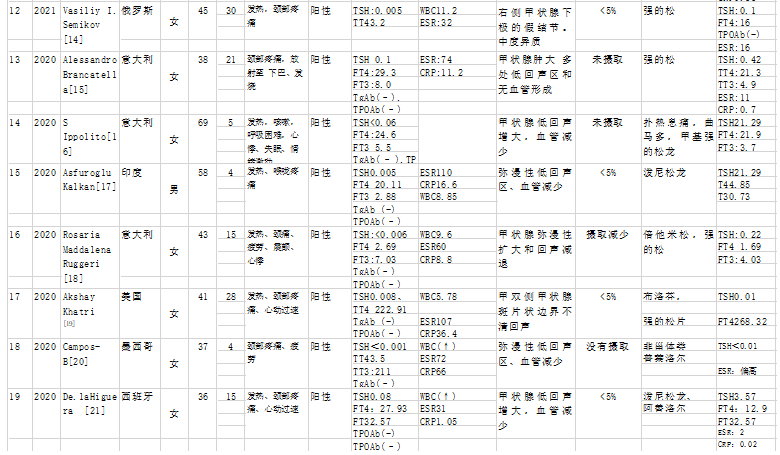
![]()
![]()
![]()

![]()
![]()
![]()
![]() 研究病案选择流程(图1)
研究病案选择流程(图1)
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
注:个案报道在当地是诊断确诊病例,排除其他病毒感染而报道。血沉:ESR erythrocyte sedimentation rate, c反应蛋白:CRP C-reactive protein, 白细胞计数:WBCs white blood cells, 甲状腺功能试验:TFTs thyroid function tests, 甲状腺球蛋白:Tg thyroglobulin, 游离T3:FT3 free T3, 游离T4:FT4 free T4, 总T3:TT3,总T4:TT4甲状腺球蛋白自身抗体:TgAb thyroglobulin autoantibodies,甲状腺过氧化物酶抗体: TPOAb,thyroid peroxidase antibody, TRAb TSH receptor antibody, (-) data not reported,正常参考值范围TSH (0.38-5.33 mIU/L) ,FT4 (7.86-14.41 pmol/L) ,FT3 (3.8-6 pmol/L) Anti TPO (0-9 IU/mL) Anti Tg (0-4 IU/mL) TRAB (<1.5 IU/L) ESR (<20 mm/h) CRP (<5 mg/L),WBC 正常范围,4-10/×109/L。
生化诊断和临床表现
SARS-CoV-2感染后的19例亚急性甲状腺炎患者和新冠疫苗接种后的20例亚急性甲状腺炎患者。准确诊断标准[40]:① 急性起病,发热等全身症状;② 甲状腺疼痛、肿大且质硬;③ ESR 增快;④ 血清甲状腺激素浓度升高与甲状腺摄碘率降低双向分离;⑤ TGAb 或 TPOAb 阴性。感染新冠病毒肺炎后和疫苗接种后发生亚急性甲状腺炎后发热人数构成比分别是30.76%(12/39)和15.38%(6/39),构成比显示无统计学差异(x2=2.66,p>0.05)。甲状腺肿大,疼痛,超声显示局部弥漫性性改变,血流减少。吸碘率或者鍀99放射核素扫描不显影。促甲状腺激素(TSH)普遍偏低,部分病例低到测不出,血清游离三碘甲状腺原氨酸(FT3)浓度,游离甲状腺素(FT4)均偏高,游离C反应蛋白(CRP)升高和红细胞沉降率(ESR)升高的临床表现,感染后和疫苗接种后亚急性甲状腺炎(SAT)临床表现和检验指标一致。感染型冠病毒后发热较疫苗后轻,伴有颈部疼痛和轻度发热,临床症状中甲状腺毒症,包括体重减轻、心悸和手部震颤多见,人口学特征和生化指标的所有实验室检查结果和临床特征见表1,表2。
症状发作 症状的发作和明确诊断时间不同 新冠病毒感染后明确诊断亚急性甲状腺炎的发病时间为为4~60天,平均(22.8±12.65)天;新冠疫苗接种后亚急性甲状腺炎明确诊断3~28天,平均(12.8±8.38)天,出现亚急性甲状腺炎的时间进行统计学比较有显著性差异(t=2.47,p<0.05)。
影像学检查
新型冠状病毒感染后亚急性甲状腺炎诊断的19例个案报道,都有典型甲状腺超声显示,即甲状腺肿大,甲状腺呈弥漫性低回声区声学改变和甲状腺血管血流减少。甲状腺超声显示异质性回声性,部分是局限性,部分结节表现。在未感染的健康人群中进行新冠病毒疫苗接种后20例亚急性甲状腺炎患者的甲状腺超声显示和冠状病毒感染后亚急性甲状腺炎的表现一致。同样也是甲状腺肿大,伴有异质性回声性和弥漫性低回声改变。甲状腺吸碘扫描或者鍀99扫描显示,患者的摄取量明显降低或者不显影。
治疗和患者随访
SAT患者亚急性甲状腺炎诊断患者接受非甾体抗炎药治疗,治疗常用药物是乙酰水杨酸、非甾体消炎药对症治疗,此类药物为解热镇痛消炎药,可以退热、止痛、减轻甲状腺炎症引起的疼痛,缓解症状。部分发热和疼痛减轻,对于非甾体消炎药治疗无效者,可应用糖皮质激素,泼尼松龙,多数治疗应用非甾体消炎药治疗有效。初始剂量较大,根据症状、体征及血沉的变化缓慢减少剂量,总疗程4-8周以上。第二种药物β受体阻滞剂,多数常规应用药物普萘洛尔片,酒石酸美托洛尔等抑制甲状腺毒症症状,对心悸症状改善作用明显,使用β受体阻滞剂可以减轻甲状腺毒症症状,减慢心率。对于疫苗接种后的亚急性甲状腺炎很少应用甲状腺素片,或者卡比咪唑。对于促甲状腺激素水平长时间高于正常水平上限,出现甲状腺功能减退早期,通常不需要治疗。如目标是将TSH控制在正常范围内,可小剂量左甲状腺素的应用,并在停药4-6周时重新评估患者的甲状腺功能,以确定是不是永久性甲状腺功能减退。本组回顾分析病例均是辅助治疗后甲状腺功能恢复,后续无持续治疗。
讨论
病毒引起亚急性甲状腺炎的机理早有研究,主要是COVID-19棘突蛋白通过受体的结合,激发免疫系统,甲状腺内血管紧张素转换酶2(ACE2)对棘突蛋白的亲和性,灭活性疫苗的结构相似的免疫原性和病毒相同,大多数针对COVID-19疫苗的病毒刺突蛋白,将其作为抗原,以引起对COVID-19的保护性免疫反应。带有冠状病毒的刺突(S)蛋白病毒进入靶细胞表面,S蛋白的表面单元S1与细胞受体的结合,病毒附着在靶细胞表面产生级联反应。此外,通过细胞蛋白酶启动S蛋白进入靶细胞,通过S1/S2和S2'位点的S蛋白切割由S2亚基驱动,允许病毒和细胞膜的融合并进入细胞。SARS-S参与血管紧张素转换酶2作为受体入口,并采用细胞丝氨酸蛋白酶TMPRSS2进行S蛋白启动(图3)COVID-19刺突蛋白(S蛋白)结合ACE2受体,ACE2受体在甲状腺在内的多个内分泌组织中具有重要表达,导致COVID-19感染后甲状腺疾病增加[41]。因此,甲状腺炎可能是由COVID-19对甲状腺的直接作用在甲状腺腺体内引起,反应到一定程度,炎症细胞因子就会迁移到甲状腺局部,吸引更多的炎症细胞并放大炎症反应[42]。另外,在细胞因子风暴中起主要作用的是细胞因子白细胞介素-6(IL-6)、IL-1RA、CCL2和CCL8(招募单核细胞和巨噬细胞)以及CXCL9和CXCL16的显著增加,它具有促炎和抗炎特性[43]。在COVID-19的促炎症反应中,细胞凋亡和局部损伤COVID-19产生宿主炎症反应,并通过表达几种病毒蛋白诱导细胞凋亡,发现滤泡上皮损伤和细胞凋亡。在COVID-19患者中,包括甲状腺在内的许多组织中都观察到炎症细胞浸润,支持炎症的潜在作用下,它受到肿瘤坏死因子(TNF)-α的刺激并激活ΝF-κΒ,因此,被认为是诱发急性呼吸窘迫综合征(ARDS)病变的发生[44]。
值得注意的是COVID-19感染可导致明显的亚急性甲状腺炎,包括典型的临床表现,颈部疼痛放射到耳根部,肌痛,轻度发热和甲状腺毒症伴C反应蛋白(CRP)/红细胞沉降率(ESR)升高;但也见于非经典/非典型亚急性甲状腺炎,无疼痛或肿胀,和感染后一样,疫苗接种后也导致明显的亚急性甲状腺炎的临床表现。从报道的案例表现中看感染新冠病毒后亚急性甲状腺炎的发热患者多于疫苗接种后的患者,这与宿主的受体反应量有关。
与COVID-19感染一样,已经描述了COVID-19疫苗接种后不同形式的甲状腺毒症,包括明显的亚急性甲状腺炎和非典型甲状腺炎,这些病例的一般特征与COVID-19感染中报告的甲状腺毒症病例相似。在灭活COVID-19疫苗和腺病毒载体的疫苗之后也有一些病例报道。已经提出了COVID-19疫苗接种与甲状腺疾病之间关联的三种机制[45]。(a)分子模拟机制:腺病毒载体疫苗和mRNA疫苗编码和灭活的全病毒疫苗含有SARS-CoV-2刺突蛋白,各种SARS-CoV-2蛋白(刺突蛋白、核蛋白和膜蛋白)与甲状腺肽肽序列在内的人七肽蛋白具有遗传相似性或同源性.因此,疫苗中的COVID-19蛋白可与甲状腺靶蛋白发生交叉反应,引起自身免疫性甲状腺疾病。通过疫苗接种多克隆活化B淋巴细胞后,针对COVID-19蛋白的抗体可能与位于甲状腺滤泡细胞上的甲状腺抗原发生交联反应,并可能促进线粒体损伤并导致甲状腺功能障碍。因此,分子模拟是COVID-19疫苗接种后自身免疫反应的潜在机制,已被提出可引起自身免疫性甲状腺疾病,例如COVID-19疫苗接种后的Graves甲状腺功能亢进症。(b)遗传易感性或易感性:在遗传易感个体中,女性发病高于男性,年龄段也相同,说明了共同特性,人白细胞抗原(HLA)基因与COVID-19抗原之间的分子模拟可以使个体易患格雷夫斯病,因为COVID-19产物会改变HLA的结构和功能。另一方面,某些类型的HLA(HLAB35)被认为对亚急性甲状腺炎易感,抗原-HLAB35复合物活化,导致免疫介导的甲状腺滤泡细胞破坏[46]。有意义是最近报道了两位姐妹在接受COVID-19 mRNA疫苗几天后出现亚急性甲状腺炎的报告[47],遗传易感性的潜在作用仍有待进一步研究。(c) COVID-19患者的B淋巴细胞与T辅助淋巴细胞反应同时发生,即从患者症状出现后一周左右开始,在SARS-CoV感染患者中,B淋巴细胞反应通常首先出现的是对核衣壳蛋白(N蛋白)的反应,在患者症状出现后的4-8天内,对S蛋白的抗体反应就会出现;中和抗体反应(可能是抵御S蛋白的反应)会在第2周开始出现,而大多数患者会在第3周出现中和性抗体;由于COVID-19的病毒滴度要比SARS-CoV更早达到高峰,因此其抗体反应可能出现地更早,因此,似乎有一部分患者并不会针对COVID-19产生持久性的抗体,关于疫苗接种后的时间间隔,正如最近在其他作者病例系列中报道的那样,COVID-19疫苗接种后的亚急性甲状腺炎发生在疫苗接种后10-14天[48]。所描述的时间过程与我们病例系列中的大多数患者一致,在接种疫苗后(12.8±8.38)天出现症状。
不同于COVID-19感染患者,疫苗注射后亚急性甲状腺炎的发生,有一种假设是疫苗佐剂,暴露于用作疫苗制剂免疫原性增强剂的疫苗佐剂,已被提出能够诱导多种免疫反应,导致了所谓的由佐剂诱导的自身免疫/自身炎症综合征(ASIA)。很难确定这种假设的自身免疫性疾病作为疫苗接种和甲状腺毒症之间的致病联系的准确性,目前不能被认为是一种普遍接受的致病机制。然而,RNA和腺病毒载体疫苗,如辉瑞,Moderna和阿斯利康疫苗中不含佐剂,它们都导致刺突蛋白表达,这与胸腺细胞膜蛋白相似,触发抗原交叉反应性和自身免疫反应。RNA和DNA疫苗均刺激细胞免疫反应[49]。因此,表达了新冠病毒感染患者和疫苗接种均在甲状腺内形成了系列反应,并非佐剂因素。